FAC モデリング概要
(財)電力中央研究所 材料科学研究所 藤原和俊
1.はじめに
火力・原子力発電用配管の減肉の主要な要因である流れ加速型腐食(Flow Accelerated Corrosion、 以下FAC)は、保護皮膜として働く酸化皮膜(マグネタイト、Fe3O4)の溶出が流れによって促進され、材料の腐食が加速される現象である(図1)1)。従って、溶液の流動条件とともに水化学および材料条件がFACの主要な影響因子となる。FACに影響を及ぼす水化学・材料因子は温度、pH、溶存酸素濃度、および合金成分濃度である。
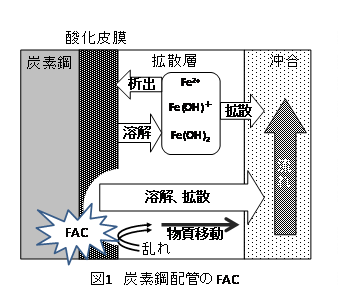 海外ではFACによる減肉量を定量的に評価するためのモデル式、評価コードが開発されており、実機の配管減肉管理に組み込まれている例もある。しかしながら、これらの評価コードには経験的なパラメータが多く含まれていると考えられるが、その詳細については公開されていない。今後、構造材料の健全性確保あるいは被ばく低減の観点から水化学管理がさらに高度化されることを想定すると、FACメカニズムの解明と、それに基づく定量的な予測モデルの確立が望まれる。
海外ではFACによる減肉量を定量的に評価するためのモデル式、評価コードが開発されており、実機の配管減肉管理に組み込まれている例もある。しかしながら、これらの評価コードには経験的なパラメータが多く含まれていると考えられるが、その詳細については公開されていない。今後、構造材料の健全性確保あるいは被ばく低減の観点から水化学管理がさらに高度化されることを想定すると、FACメカニズムの解明と、それに基づく定量的な予測モデルの確立が望まれる。
現在、国内で開発されているモデルは、溶存酸素の効果を加味し水化学因子を考慮している。本章では、電力中央研究所で構築したFACモデル式を中心に、FAC予測評価技術の現状と課題を説明する。
2.FAC現象に関する知見の整理
FACに影響を及ぼす因子は、①マグネタイトの安定性に関係する水化学因子(温度、pH、溶存酸素濃度)、②材料因子(合金成分濃度)、および、③溶解したFeの皮膜表面から水側への移動に関係する流体力学因子に分けることができる。水化学因子および材料因子の影響について、既存の知見を整理した結果を表1および図2に示す。単相流での炭素鋼のFACは幅広い温度域で発生し、減肉速度が最大となる温度域は広いpH範囲(pH7~9程度)で150℃付近となる2),3)。これに対し、ステンレス鋼では、その温度域が高くなるようである4)。一方、二相流では、炭素鋼のFAC速度が最大となる温度域は180℃近辺であるといわれている5)。また、pHの影響についてはpHが高くなるに従いFAC速度は低下し、pH9.5以上では減肉速度は0.01mm/y以下と非常に小さくなるといわれている6)。溶存酸素濃度については、中性水中では15~40 ppb、アルカリ溶液中では数十ppb以上であれば、FACを抑制できると考えられている7,8,9,10,11)。材料中へのわずかなクロムの添加がFAC速度を抑制することが知られており、中性溶液、アルカリ溶液ともに1 wt%以下のクロムの添加によりFAC速度を一桁以上低下させることができる7),12)。
表1 既存知見の整理
| 影響因子 | FAC現象 | 参考文献 | |
| 水化学
因子 |
温度 | 減肉速度が極大となる温度域が存在し、その温度は流束には依存しない。
〔単相流-炭素鋼: 130℃-150℃(pH7~9)〕 〔単相流-ステンレス鋼:240℃(pH7~9)〕※1 〔二相流-炭素鋼: 180℃ (pH9)〕 |
2),3) 4) 5) |
| pH | pHが高くなるに従い減肉速度は低下する。
〔pH9.2以上:急激(指数関数的)に減肉速度が低下。〕 |
6),3) |
|
| 溶存
酸素 濃度 |
それ以上の濃度であれば、減肉速度が極めて小さくなるしきい溶存酸素濃度が存在する。
〔中性(pH7)でのしきい溶存酸素: 15~40 ppb〕 〔アルカリ溶液(pH9)でのしきい溶存酸素: 1~2 ppb〕 〔しきい溶存酸素は、減肉速度、水の密度および酸素の物質移動係数により評価可能〕 〔しきい溶存酸素以下の溶存酸素濃度では、FAC速度におよぼす溶存酸素濃度の効果は小さい〕 |
7),8),9) 9),10) 11)
9) |
|
| 材料
因子 |
クロム含有率 | 材料中のCr, Mo, CuはFACを抑制することができる。
〔中性(pH7)での効果:Cr濃度>0.5wt%でFAC速度を1/10以下に低減。〕 〔アルカリ溶液(pH9)での効果:Cr含有量が0.01から0.1wt%と増加すると減肉速度もほぼ1/10となる。〕 |
7) 12) |
※1:ステンレス鋼からのコバルト溶出速度
注)表中のpHはいずれも室温の値である。
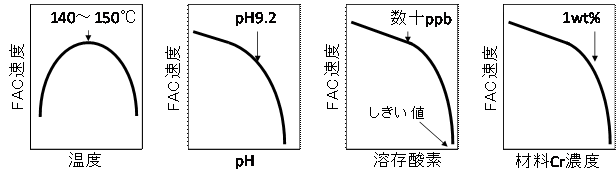 図2 FACに及ぼす水化学、材料因子の影響
図2 FACに及ぼす水化学、材料因子の影響
3.FAC予測モデル式の現状
表2に主なFAC予測評価式を示す。流れ加速腐食の物理モデルを検討した例にはSanchez-Caldera13)、Bignoldら14)およびListerら15)のモデルがある。近年では国内でも内田ら16)および藤原ら17)によりモデルが提案されている。
Berge18)らは、物質移動過程とともに溶解過程を考慮し、速度式を導き出している。この場合、物質移動過程と溶解過程のいずれが律速過程かは物質移動係数(k)および溶解速度定数(kc)の相対的な大小に依存することとなる。Sanchez13)らは、金属/酸化物界面での水酸化鉄の生成がFAC速度を律速すると考え、金属/酸化物界面から酸化物/流体界面への拡散(D)、皮膜厚さ(δ)、酸化物の空孔率(θ)を考慮したモデル式を提案している。Bignold14)らは、腐食電流密度が物質移動速度に比例すると考え、減肉速度はk3に比例するとのモデル式を提案している。Listerらは、CANDU炉運転条件下での実験データにもとづき、FAC速度モデルを構築している15)。
Bergeら、Sanchezらより提案されているモデルは、水化学因子の影響はFeの溶解度として扱われている。しかしながら、鉄の溶解度計算に必要な水素分圧の扱いなどが明確ではなく、また溶存酸素の効果については触れられていない。前述のとおり溶存酸素の給水への添加はFACの抑制に有効な方法であることから、その作用機構を定量的に明らかにすることはきわめて重要な課題である。
材料中のCr濃度の影響については、表面に生成する酸化皮膜の性状(空孔率)に影響を及ぼすと考えられるが、必ずしも明らかとはなっていない。
表1 主なFAC予測モデル式
| モデル式の概要 | 評価可能な水化学因子 | |||||
| 温度 | pH | DO | Cr | |||
| 海外のモデル | Bergeら | FAC=
k・kc/(k+kc)・(Ceq-Cb) |
○ | ○ | × | × |
| Bignoldら | FAC∝
4k3[H+]8/(K3・B2)・exp(2FE0/RT)) |
○ | ○ | × | × | |
| Sanchez | FAC ∝
Ceqθ/[ 1/kc + 1/2(δ/D + 1/k)] |
○ | ○ | × | △ | |
| Listerら | FAC∝D・θ・(Cm/o-Co/s)・(1-θ)/δ | ○ | ○ | × | △ | |
| 国内モデル | 内田ら | 静的な電気化学モデルFAC=f(E、Ceq、δ、・・・)
動的な皮膜成長モデルFAC=f(Ceq、δ、・・・) |
○ | ○ | ○ | ? |
| 藤原ら | FAC=(1-θCr)kCeq
Ceq=f(T, DO, CNH3), θCr=f(XCr) |
○ | ○ | ○ | ○ | |
3.最近のFAC予測評価式の例
内田らは、母材および酸化皮膜の溶解速度は酸化皮膜厚さにより抑制されると仮定し、電気化学モデルと二層酸化皮膜モデルを組み合わせによりFAC速度のモデル式を立案している16)。内田らのモデルでは溶存酸素とともにヒドラジンの影響も考慮されている。
図3に我々が想定したFACモデルの模式図を示す。本モデルでは以下のプロセスを仮定している。なお、モデルの詳細については文献(17)を参照とする。
1) 炭素鋼表面には酸化物層が存在する。
2) 酸化物層表面には、Fe2+の飽和溶解層が存在する。
3) 飽和溶解層と沖合い溶液の間に拡散層が存在し、溶存化学種の拡散が定常状態でのFAC速度を決定する。
飽和溶解層での化学種Mの濃度(Cs,M)と沖合い溶液の濃度(C∞,M)の間に差がある場合、その流束(JM)はFickの法則に従い濃度差(Cs,M – C∞,M)に比例する。
JM = 2(DM/δ)•(Cs,M – C∞,M) (1)
DM:物質Mの拡散係数、δ:拡散層の厚さ
炭素鋼中に含まれる微量なCrはFAC速度に影響を及ぼす。我々は、表面に生成するCr酸化物の面積率をθと定義した。ここで、炭素鋼は均一に腐食する、すなわち、定常状態ではFeとクロムの流束の比が材料組成と一致すると考え、炭素鋼中のFe含有率(XFe)、Cr含有率(XCr)、JFeおよびJCrの関係よりθを求めた。
θ = XCr•SFe•MFe/{(100-XCr)•SCr•MCr + XCr•SFe•MFe} (2)
Cs,Feを鉄の溶解度(SFe)とすると、JFACは以下の式で表せる。なお、ここではC∞,Feは小さく無視できるものと仮定した。
JFAC = (1-θ)(2DFe/δ)•SFe (3)
SFeの算出には飽和溶解層での水素イオン濃度([H+])および水素分圧(PH2)が必要となる。[H+]は、Fe2+およびCr3+の溶解平衡、アンモニアの加水解離平衡、電荷バランスを考慮し求めた。PH2はCs,H2を算出しヘンリーの法則より求めた。なお、Cs,H2は腐食によるH2の生成速度、O2の消費速度およびJH2、JO2のバランスを考慮し算出した。
図4にFACモデルにより求めたFAC速度に及ぼす温度、pH、溶存酸素濃度およびクロム含有率の影響を示す。FAC速度の極大値は中性溶液中では130℃近辺に生じる。pH25℃の増加につれてFAC速度は小さくなり、pH25℃8.5以上では指数関数的に低下する。溶存酸素濃度の増加と共にFAC速度は徐々に小さくなる。XCrの増加と共にFAC速度は低下し、XCr > 0.01 wt%以上では急激に減肉速度が低下する。これらの図4に示す挙動は表1に示したFAC現象を概ね再現していると言える。
5. まとめおよび今後の課題
現在国内で開発されているモデルは、溶存酸素の効果など水化学・材料因子を考慮しており、その影響を定性的に説明することが可能である。 しかしながら、FACは、物質移動と密接に関係するため、その速度の定量的な予測のためには流動面での研究成果を融合させ、予測精度を向上させるとともに、実機データによる妥当性検証を行う必要がある。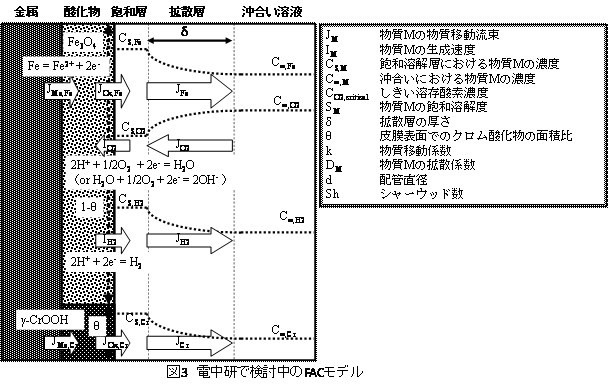

引用文献
1) JSME S CA1-2005(2005).
2) H. G. Heitmann and P. Schub, Proc. Third meeting Water Chemistry of Nuclear Reactor, BNES, London, UK, p.243(1983).
3) G. J. Bignold, K. Garbett and I. S. Woolsey, in Ph. Berge and F. Kahn, eds., Corrosion-Erosion of Steels in High Temperature Water and Wet Steam, (France: Electricite de France, Les Renardieres, 1982)Paper No. 12.
4) Y. Ozawa, S. Uchida and M. Kitamura, J. Nucl. Sic. and Technol. 20, 1039(1983).
5) H. Keller, VGB-Kraftwerkstechnik, 54, 292(1974).
6) H. G. Heitmann and W. Kastner, VGB-Kraftwerkstechnik, 62, 211(1974).
7) 日本原子力学会編, 原子炉水化学ハンドブック, コロナ社(2000).
8) 泉谷雅清, 水庭文夫, 大角克巳, 神林剛, 松島雍憲, 丹野和夫, 火力原子力発電, 27, p.419(1976).
9) K. Fujiwara, M. Domae, T. Ohira, K. Hisamune, H. Takiguch, S. Uchida and D. Lister, Proc. 16th Pacific Basin Nuclear Conference (16PBNC), Aomori, Japan, P16P1048 (2008).
10) O. de Bouvier, M. Bouchacourt and K. Fruzzetti, Proc. Int. Conf. Water Chemistry in Nuclear reactor System, Avignon, France, Paper No. 117(2002).
11) I. S. Woolsey, G. J. Bignold, C. H. DE Whalley, K. Garbett, Proc. Water chemistry for nuclear reactor system 4, BNES, London, p.337(1986).
12) K. Murata, T. Tsuruta, S. Tokunaga, K. Yamamoto and Y. Shoda, 材料と環境2006 予講集, A-201, JSCE(2008).
13) L. E. Sanchez-Caldera, “The Mechanism of Corrosion-Erosion in Steam Extraction Lines of Power Stations”, Ph. D. Thesis, Department of Mechanical Engineering, Massachusetts Institute of Technology, Cambridge, Massachusetts (1984).
14) G. J. Bignold, K. Garbett, R. Garnsey and I. S. Woolsey, Proc. Second Meeting on Water Chemistry of Nuclear Reactors, British Nuclear Engineering Society, London, (1980) 5.
15) D. H. Lister and L. C. Lang, Proc. International Conference on Water Chemistry of Nuclear Reactor Systems, Avignon, France, April, (2002)
16) S. Uchida, et al., Journal of Nuclear Science and Technology. 46 [1] , 31-40 (2009).
17) 藤原和俊, 堂前雅史, 太田丈児, 米田公俊, 稲田文夫, 電力中央研究所報告, Q08016(2008).
18) P. Berge, J. Ducreux, and P. Saint-Paul, “Effects of chemistry on corrosion-erosion of steels in water and wet steam,” in Proceedings of the Second Meeting on Water Chemistry of Nuclear Reactors, British Nuclear Engineering Society, London, (1980) 5.